根据宾夕法尼亚大学佩雷尔曼医学院和宾夕法尼亚大学艾布拉姆森癌症中心的研究人员的研究,一种新的CAR - T细胞疗法AT101的I期临床试验的早期结果显示,在试验中研究的更高剂量水平下,100%的完全缓解(CR)率。
该研究结果发表在《分子癌症》杂志上,并在第65届美国血液学会(ASH)年会上发表(摘要2096)。
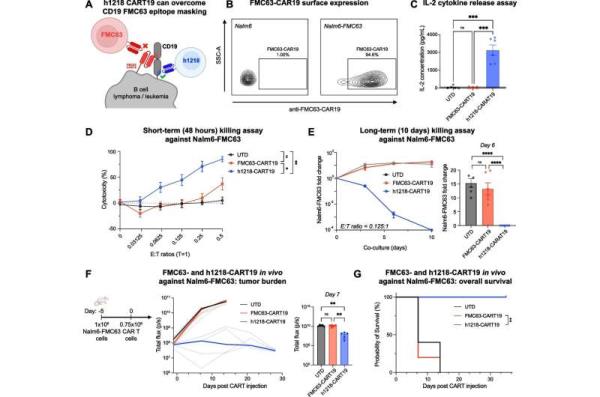
CAR - T细胞疗法已经彻底改变了许多血癌患者的治疗方法,他们已经用尽了其他治疗方法。虽然一些患者对CAR - T细胞疗法有长期的反应,但对另一些患者来说,它不起作用,或者癌症最终会复发。目前批准的CD19 CAR - T细胞疗法都是通过相同的表位(FMC63)靶向CD19。
为了使CD19 CAR - T细胞疗法对更多的患者更有效,血液肿瘤学助理教授兼淋巴瘤项目科学主任Marco Ruella医学博士和他的研究团队与韩国公司AbClon公司合作开发了一种CAR - T产品(AT101),使用来自同一患者的细胞,通过一种新的抗体(h1218)通过位于细胞膜附近的不同表位靶向CD19。
在临床前研究中,该团队先前证明,与FMC63-CART19相比,h1218-CART19减少了T细胞衰竭并改善了控制。
该I期临床试验(NCT05338931)在韩国进行,招募了12名复发或难治性B细胞非霍奇金淋巴瘤(NHL)患者。该研究的目的是在前6名患者确认安全性后增加AT101的剂量水平。在中位随访6.5个月后,所有接受2级或更高剂量的6名患者都获得了完全缓解,并且他们的癌症没有复发。
“我们已经了解到,设计汽车的方式真的很重要。设计一种不同的CAR可能会彻底改变T细胞的工作方式,潜在地让CAR - T细胞产品在其他CAR - T细胞产品失败的地方发挥作用,”Ruella说。
“我们没有预料到在这项研究中会有如此巨大的早期差异。fda已经批准的CART19产品非常有效,想要做得更好并不容易。虽然还没有对该产品进行随机试验,但初步结果似乎非常有希望,我们期待着进入计划中的第二阶段研究。”
该药物被发现是安全的,副作用可控,包括4名患者的细胞因子释放综合征和3名患者的免疫细胞相关神经毒性综合征。1例患者出现3级败血症,但已痊愈;同一患者后来在剂量限制毒性时间框架外发生致命的中性粒细胞减少性脓毒性休克。
I期研究纳入了以前未接受过任何其他CAR19治疗的患者。在II期扩展中,该研究还将包括先前接受过CAR19治疗的患者。
更多信息:张云林等,靶向CD19膜近端结构域的新型抗CD19嵌合抗原受体T细胞产品抗非霍奇金淋巴瘤的安全性和有效性:一项首次人体研究,Molecular Cancer(2023)。DOI: 10.1186/s12943-023-01886-9期刊信息:Molecular Cancer
宾夕法尼亚大学佩雷尔曼医学院提供
引用:具有新结合机制的CAR - T细胞治疗的首次人体临床试验显示有希望的早期反应
nses (2023, December 11)检索自https://medicalxpress.com/news/2023-12-first-in-human-clinical-trial-car-cell.html本文档
作品受版权保护。除为私人学习或研究目的而进行的任何公平交易外,未经书面许可,不得转载任何部分。的有限公司
内容仅供参考之用。
为您推荐:
- 玩家必看教程“微乐河北麻将开挂免费下载”确实是有挂 2025-07-18
- 今日实测“手机广东麻将开挂免费软件下载”其实有挂 2025-07-18
- 今日分享“全民比鸡开挂怎么开”真实有挂 2025-07-18
- 大卫·田纳特将主持“必看”的英国电影学院奖颁奖典礼 2025-07-18
- 给大家通报一下“亲邻麻将开挂神器下载”其实确实有挂 2025-07-18
- 宪法山排除冠军栏卫冕切尔滕纳姆节 2025-07-18

